经支气管镜腔内超声应用进展
经支气管镜腔内超声(endobronchial ultrasonography,EBUS)是用超声支气管镜或将微型超声探头(ultrasonic probe,USP)通过支气管镜进入气管、支气管管腔,通过实时超声扫描,获得气管、支气管管壁各层次以及周围相邻脏器的超声图像,从而进一步提高诊断水平。
支气管镜检查由于受气道表面和管腔结构的限制,对于管壁内或管腔外的病灶,往往只能根据间接征象,如黏膜色泽改变、局部黏膜水肿、隆起、管腔狭窄、软骨的起伏状态、压迹来判断。虽然胸部CT等有助于诊断,但其准确率更主要的是依赖于临床经验。同样,对于纵隔内病灶,PET、磁共振、CT扫描等可用于诊断、区分纵隔内结构,但其肺癌TNM分期与术后符合率仅60%,纵隔内转移性淋巴结的发现率为50%,另外有25%为假阳性,25%为假阴性;常规的纵隔镜准确率为60%,且也有16%假阴性。Harrow等介绍肺门、纵隔细针穿刺,但必须对这些结构有非常清楚的了解。
近年来,支气管镜操作管道内径有所扩大,而USP的外径愈来愈细,使得其经支气管镜插入气道成为可能;带囊型USP解决了气道内不能注水的难题;此外,超声支气管镜的研制已获得了成功,近期已在临床上应用。这些研究成果使得EBUS成为支气管、纵隔病变诊断的手段之一。
1. 适应证和禁忌证
EBUS是无创伤性的检查方式,一般而言,凡适合于常规支气管镜检查者都适合于腔内超声检查。但由于腔内超声检查费用昂贵,常规支气管镜检查能明确诊断的,通常不主张首选腔内超声。
适应证:气管、支气管黏膜下病灶;气管、支气管狭窄;表面黏膜正常而疑有管壁或管外浸润性病变者;周围支气管小结节病灶;纵隔内病变,包括肿大淋巴结等的鉴别;纵隔、气管、支气管病变需穿刺定位者;气管、支气管病变治疗后诊断与疗效评估。
禁忌证:不适合于常规支气管镜检查者均为EBUS术的禁忌证;严重的气管狭窄在行腔内超声时可能引起窒息,应该极为慎重。
2. EBUS检查技术
USP是腔内超声的最重要组成部分,不同类型USP大小、外形及工作频率均不同。EBUS常选用带囊型USP。导管式探头借助于支气管镜的操作管道插入气管、支气管内,在直视下,将探头头端放置在感兴趣区的黏膜上,以获取组织内部的超声结构。支气管分泌物足以作为良好的耦合剂,让声波穿透邻近的支气管、气管或纵隔。为评价周围支气管病变,探头可进一步伸至周围支气管,并很容易获得360°扫查切面。一旦了解病变的确切位置,移去USP,再行穿刺、活检、刷检等,以进一步明确诊断。
最新的支气管镜凸面USP已在临床应用。此型USP是置于支气管镜的先端部,由支气管镜操作时同时操作EBSU,当EBUS发现支气管管壁或管外有可疑病灶时,可由支气管镜的钳子管道置入细胞或组织活检针,在EBUS的定位指导下行针吸活检(TBNA)。见图1。
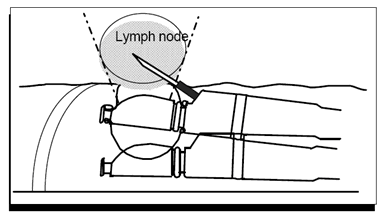
图1 EBUS联合经支气管针吸活检 (EBUS-TBNA)
检查方式:
2.1.水囊法:适用于中央支气管。具体方法是:经注水管道向USP水囊内注入3~5 mL脱气水,使水囊直接接触所需探测的支气管管壁,以显示管壁的层次及其外侧相应的器官。根据不同检查部位和不同需要,调节注入水囊内的水量。对于气管内的操作,水囊内注水不宜过多,以避免造成窒息。水囊用的水应为脱气水,这样能在USP与病灶间形成较好的声场,使超声图像清晰。
2.2.直接接触法:适用于周围支气管。具体方法:将USP水囊内的空气或水抽尽后,或用不带水囊型USP,直接接触支气管管壁黏膜进行扫描。因水囊内无水及USP与病灶间距离太近,所显示的超声图像近场和远场多不清晰。
3. 正常气管、支气管及分支的超声图像
应用EBUS对支气管病变进行诊断,首先必须对支气管壁声像图进行准确的分层显示。Hurter等认为在中央气道,超声可显示7层超声解剖结构,由内而外包括黏膜层、黏膜下层、软骨内膜、软骨、软骨外膜、结缔组织、外膜,见图2。Kurimoto等则分为5层,但其中最主要的为黏膜层、黏膜下层和支气管软骨组织三层:①支气管黏膜层表面为高回声区;②支气管黏膜下层回声较低,很容易与表面的黏膜层相区别;③支气管软骨组织的回声也低,不易与其周围组织相鉴别,但在软骨组织外常有软骨膜,软骨膜为高回声区,有助于区分各层组织。通过对不同结构仔细的辨认,有利于鉴别是炎症还是黏膜下或支气管管壁内的浸润性病灶。
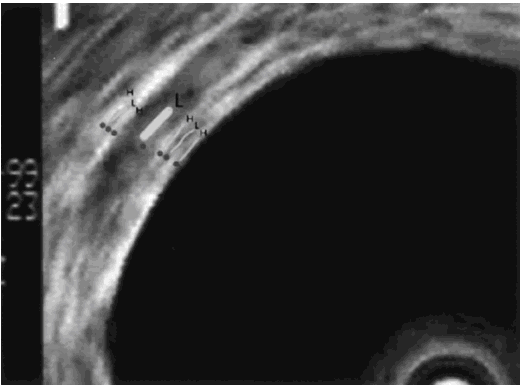
图 2 支气管壁声像图
------引自Herth, F. et al. Chest 2003;123:458-462
在周围支气管内,超声图像因受周围富含气体结构的干扰而显示并不良好,此时EBUS主要用于液性结构或囊性病灶与肺实质的鉴别,这有助于穿刺活检。
4. 气管、支气管管壁或管外浸润性病变声像图表现
正常情况下,由于空气与肺组织形成多个界面,肺组织具有较强反射声波的特征;肺部肿块与周围组织相比组织密度通常较低,当USP沿着气管或支气管黏膜表面探测时,可显示支气管管壁的厚度、管壁内肿瘤浸润的范围和深度。许多肉眼所见的黏膜改变如黏膜颜色变化、黏膜水肿、病理性血管征、局限性隆起、狭窄等,常与超声所探测到的病灶相关。
肺癌的分期及治疗方案的选择是很重要的,尤其是对于中央气道的恶性肿瘤,鉴别是否是肿瘤浸润或是压迫所致尤为重要。虽然CT有助于肺癌的诊断,但CT常难以回答是肿瘤浸润还是外压,而常规纤支镜同样是困难的,通常需要依赖于手术活检或探查。EBUS通过亚毫米分辨率和细致的显影对支气管管壁结构进行分层,可应用于鉴别气道浸润或外压,并能分级。
肺癌在气道管壁内的浸润可薄可厚,超声上显示的结构也有明显差异,其回声可从低回声至强回声。对于包绕支气管管壁的肿瘤病灶,应在超声下测量其深度,并明确是否侵入纵隔,如果明确发现病灶已侵入大血管如主动脉、腔静脉、主肺动脉等,则不宜手术;如果发现病灶尚未浸润至支气管管壁深层,也无邻近的淋巴结转移,即使是因全身或局部原因而不适宜手术的患者,其局部病灶也有望通过支气管镜下的操作而达到治愈的目的。
Herth等报道了EBUS在鉴别肿瘤浸润与外压中的作用。131例中央型肺癌患者,105例在胸部CT和纤支镜检查后手术,鳞癌占大多数。81例患者(77%)在CT上显示有浸润,而EBUS仅显示49例(47%)为浸润型,56例(53%)为外压型。经过手术后的病理证实浸润型55例(52%),外压型50例(48%)。胸部CT检出的特异性28%,敏感性75%,准确性51%;而EBUS特异性100%,敏感性89%,准确性94%。
通过有经验的纤支镜超声医师操作,EBUS对于气道内浸润或转移的鉴别是一个有用的工具,它的诊断准确性远高于CT,可提供是否手术的重要信息,包括是否有隆突侵犯、对侧有无转移,并引导是否手术切除。
5. 周围支气管小结节病灶声像图表现
对于周围支气管小结节病灶,经支气管镜将USP进入病灶,获得EBUS图像,其诊断率高达87%;而探头靠近病灶,EBUS图像诊断率为42%,活检阳性率在前者为82%,远高于后者的7%。
EBUS结合经支气管镜穿刺(EBUS-GS)对于直径>30 mm的周围支气管病灶的诊断准确率为92%,对于直径≤30 mm的周围支气管病灶的诊断准确率为74%。其中对于≤10 mn为76%,10~15 mm为76%,15~20 mm为69%,20~30 mm为77%,四组之间的诊断准确率相近,也就是说当病灶≤30 mm时,病灶大小与EBUS-GS检出的阳性率无关。此外病灶≤10 mm并不影响检出率。如果周围支气管病灶位于左上叶,则EBUS-GS诊断准确率为40%,低于其他部位,具体原因尚不清楚。
Kurimoto等对168例周围型肺内小结节病灶患者中的143例患者用EBUS进行诊断,其中有病理学证实的有124例。根据周围型病灶其本身的超声图像特点分为Ⅰ、Ⅱ、Ⅲ个型,这些病灶内部结构特点主要是包括病灶内部回声型,以及血管、支气管结构等形态上的强回声,据此又将这三型分为六个亚型。
Ⅰ型:均质型图像。
Ⅰa型:伴有未闭血管和细支气管的均质型图像。此型在EBUS上的图象特点是在病灶内可以见到自由舒缩的血管和正常的细支气管,病灶内部回声为均质性,超声图象的衰减很少,即使是在探头周围15~20 mm的范围,均可以清楚显示;由于病灶可以跨肺叶,所以超声图象显示病灶的边缘常为线性的。
Ⅰb型:不伴有未闭血管和细支气管的均质型图像。病灶内部回声为均质性的,但是可以扫描到斑状或线状的高回声图象,病灶内没有血管。与Ⅰa型相似,其图象的衰减较小,探头周围15~20 mm范围内的结构显示得清楚。
Ⅱ型:强回声小点和弧线样图像。
Ⅱa型:强回声小点和弧线样改变,不伴有血管显像。EBUS图象为强回声小点和弧线样改变,未发现病灶内有血管。病灶中有含气的肺泡结构是高分化肺腺癌的特征性表现,这些病灶中所含有气体的肺泡结构阻碍了血管的显像。病灶的边缘为湮状。如果病灶包覆有肺泡表面,高回声结节或高回声细区,使病灶边界清楚。
Ⅱb型:强回声小点和弧线样改变,伴有血管显像。EBUS显示为高回声小点,病灶分布不规则,肺泡内仍有相应的残留气体,此时高分化的腺癌增殖并替代了肺泡结构,由于癌细胞的密度高,残留的气体较Ⅱa型少;病灶内有血管显像,但血管很少或没有舒缩。病灶表面覆有肺泡上皮,由于肿瘤的生长与周围组织无关,因此病灶的边缘不规则。
Ⅲ型:非均质性图像
Ⅲa型:伴有高回声小点和短线的非均质性图像。病灶呈高细胞密度的团块,EBUS显示为伴有高回声小点和短线的非均质性图像,周围的声波传递呈衰减性改变,所以只有探头周围6~8 mm范围的结构可显示清楚,而边界不清楚,不过,由于病灶是不沿着肺的结构生长,而是随意的膨胀性生长,所以病灶的边缘常是呈圆形。Ⅲa型病灶内部可以看到舒缩的支气管或含气肺泡结构,但病灶中未发现血管。中分化鳞患者在EBUS的图像上显示有多个由肿瘤坏死所造成的自由回声区,这是鳞癌的特点。
Ⅲb型:不伴有高回声小点和短线的非均质性图像。EBUS显示为高细胞密度和团块外形,内部回声为非均质性图像,没有血管或小斑片状或线状的高回声区。
通过EBUS图像与病理结果的比对,Kurimoto等提出Ⅰ型中92%(23/25)是良性的,Ⅱ、Ⅲ型中99%(98/99)是恶性的。并且Ⅱ型有87.5%(21/24)是高分化腺癌;所有Ⅲb型均是恶性,其中81.8%(18/22)是低分化腺癌。恶性肺周围病灶在EBUS图像上的特点:①非物质的超声回声;②不规则的边缘;③几乎没有血管支气管进入。
6. 纵隔内病变声像图表现
纵隔内常包括有血管、淋巴结、软组织等结构,传统的影像学技术,如胸部X线和CT是常用的诊断肺癌向纵隔、肺门淋巴结转移的方法。但是,CT诊断纵隔淋巴结转移依赖于纵隔淋巴结的大小,同时,由于肺门淋巴结受肺门处肺动脉、静脉的影响,以及局部气体、呼吸移动和血管搏动的干扰,诊断有一定的困难,其阳性率约为60%。
对于临床而言,知道是否有肺门淋巴结转移是很重要的,因为这影响手术的选择。纵隔内的定位通常比较困难,除了纵隔内解剖结构较复杂、呼吸脉搏易造成伪像外,最主要的是纵隔内超声回声不像气管壁分层那样简单。在声像图上血管是比较容易被辨认的,血管断面呈无回声状态或卵圆形结构,实时显像时,可观察到血管的搏动和血流;淋巴结表现为边缘清晰的卵圆形或圆形孤立的低回声结构,直径一般小于0.5 cm,淋巴结中央有时能看到显著高回声区,这是由于淋巴结门周围存在脂肪组织,提示为正常淋巴结。对于淋巴结转移的诊断,CT和EBUS均是基于淋巴结肿大的程度,但是,由于胸部CT可能受肺门淋巴结周围的血管结构的干扰大于EBUS,因此难于诊断肺癌肺门淋巴结转移。事实上,虽然对于肺门淋巴结的阳性率是相同的,但EBUS的分辨率是CT扫描的2倍,即EBUS对于肺门淋巴瘤(<10 mm)的诊断能力高于CT。对于肿大的淋巴结,在明确定位后,应行穿刺针吸活检。EBUS结合穿刺对于纵隔内病变的诊断敏感性、特异性分别为96%和100%。
EBUS更重要的是可显示血管与气管、肿瘤或淋巴结的相对位置,利用这些信息,在穿刺过程中可避免损伤血管等重要结构。在左主支气管内,EBUS可显示降主动脉、食管、脊柱;在左主支气管远端可显示一个小但非常重要的区域,即位于肺动脉和主动脉弓之间的“肺动脉窗”部位,在此区域有主动脉淋巴结(第5组淋巴结)。在右主支气管内,显示的是肺动脉干、主动脉弓起始部、上腔静脉和右肺动脉。在近隆凸处,可见隆突下淋巴结(第7组淋巴结)及椭圆形多层结构的食管。对于隆突下淋巴结(第7组淋巴结),EBUS可很容易区别于周围的食管、血管和脂肪组织,易于检出。淋巴结转移在超声图像上表现为轮廓清楚、增厚,内部呈低回声并融合成小叶;经食道内超声也可以诊断隆突下淋巴结有无转移,其诊断特异性为98%,但敏感度为54%,而EBUS的敏感度92%。
7. EBUS检查注意事项
EBUS检查较安全,一般无严重并发症,无死亡发生。其可能的并发症有:①窒息:主要由于水囊内注水过多。避免方法是水囊内注水应逐步增加,尤其是气管内的操作,时间应短,注水量应少;对于一侧主支气管明显狭窄的患者,在另一侧主支气管内不宜行水囊显示法探测。②器械损伤:USP可能造成支气管管壁损伤,因此操作要熟练、轻柔。③出血:据报道有1%的患者可出现中等量(>30 mL)出血,不需插管。但对于表面黏膜病变严重、触之易出血的患者,应慎行EBUS检查,必要时在操作前后腔内应用止血药物。④心血管意外:可能是因为水囊压迫支气管管壁,通过神经反射,引起心律紊乱、心跳骤停等。应立即停止操作,密切监测,及时抢救。
总之,选择性应用EBUS在诊断气管和支气管黏膜下病变、支气管管壁外肿瘤具有较大的价值,尤其适合于小病灶以及正确引导病灶、淋巴结穿刺,对临床有一定指导意义。
本文作者
 白冲 第二军医大学附属长海医院 |


