体外膜肺氧合(ECMO)在极重度呼吸衰竭救治中的应用
正压机械通气是呼吸衰竭最为有效的常规支持治疗手段,可满足大部分患者的通气需求。但对于病情极重的呼吸衰竭患者,如重症ARDS、肺炎、大面积肺栓塞、支气管哮喘以及部分需要接受肺移植的终末期肺病患者,常规正压通气常常难以维持满意的通气和氧合。而且,由于这些患者需要长时间的高气道压力和高浓度氧的支持,其发生潜在呼吸机相关并发症的风险大大地高于一般呼吸衰竭患者。对于已合并有严重机械通气并发症(如气压伤和呼吸机相关肺部感染)和合并症(如心功能不全,休克等)的患者,正压通气往往处于顾此失彼、进退两难的尴尬境地。最终,这些患者或因难治疗性低氧和严重CO2潴留,或因严重机械通气并发症而死亡。因此,许多学者一直在努力寻找另一种更有效、更安全的呼吸支持手段以替代传统的正压通气,以避免上述临床困境。近年来,技术日益成熟的体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)为我们在呼吸支持领域指明了另一个方向,为极重度呼吸衰竭患者带来了新的希望[1]。
ECMO是体外肺辅助(extracorporeal lung assist, ECLA)技术中的一种,在临床中应用已有30多年历程,主要用于部分或完全替代患者心肺功能,让其充分休息。体外膜氧合的主要原理是通过静脉内导管把静脉血引出体外,然后经过体外氧合器进行氧合,氧合后的血液再重新通过静脉/或动脉输回体内。按照治疗目的和血液转流方式,ECMO可分为静脉-静脉方式ECMO(V-V ECMO)和静脉-动脉方式ECMO(V-A ECMO)两种(如图1所示)。V-V ECMO适用于仅需要呼吸支持的患者,V-A ECMO可同时支持呼吸和循环功能,为患者提供足够的氧供和有效的循环支持。V-V方式比V-A方式的并发症和病死率都较低[1] ,对于呼吸衰竭患者,V-V ECMO是最为常用的方式,可部分替代肺脏功能以维持基本的氧合和通气,让肺脏充分休息,最大限度地降低呼吸机支持水平以预防和减少呼吸机相关肺损伤的发生,为原发病的治疗争取时间。
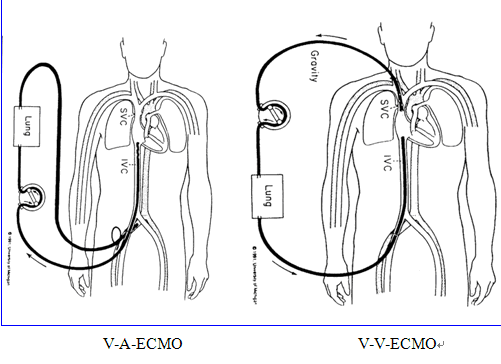
图1 ECMO的治疗模式
1972年,Hill等首次报道了ECMO在一例22岁ARDS患者中的成功应用[2] 。此后,很多学者都报道了关于此技术在成人ARDS患者中成功应用的病例,这促使了1979年第一个关于ECMO临床应用的随机对照研究(RCT)的产生。该研究共有90例重症ARDS患者随机接受传统通气治疗和ECMO治疗,但结果未显示两组间病死率的差异(90% vs 92%)[3] 。在沉寂15年之后,1994年由Morris等完成了第二个关于ECMO治疗重症ARDS的RCT,但也未得出阳性结果[4] 。上述两个RCT研究都未能得到阳性结果,分析这可能与当时很多因素有关,如对疾病认识的不足、病例选择的不恰当、通气策略选用的不合适、ECMO相关设备及技术的不成熟和研究中很多参与单位无丰富的ECMO治疗经验等。又一个15年之后,2009年,JAMA杂志上发表的一篇关于ECMO治疗因甲型H1N1感染导致的重症ARDS患者的临床观察研究,约1/3的机械通气患者(68例)接受了ECMO治疗,患者的存活率高达79%[5] 。几乎是同时,Peek GJ等在Lancet杂志发表了第三个ECMO治疗ARDS的多中心RCT(CESAR研究,Conventional ventilation or ECMO for Severe Adult Respiratory failure),共有103家医院参与。该研究的入选标准是:年龄在18~65岁之间;病情可逆的严重呼吸衰竭;Murray评分大于或等于3分;高碳酸血症(pH<7.2)。排除标准包括:高通气支持水平(峰压>30cmH2O,FiO2>0.8)应用大于7天;颅内出血;有应用肝素的禁忌等。入选患者随机接受ECMO治疗和传统通气治疗。入选ECMO组的患者被转诊到指定的ECMO治疗中心(Glenfield Hospital,Leicester,UK)接受治疗,传统通气治疗组则在当地医院接受治疗。ECMO组采用V-V ECMO的治疗方式,应用滚压泵维持较高的血流量。此外,在ECMO治疗中逐渐降低呼吸机支持水平让肺脏充分休息:气道峰压不超过20 cmH2O ~25 cmH2O,呼气末正压(PEEP)设置为10 cmH2O ~15 cmH2O,呼吸频率10次/分,FiO2为0.3。肝素用量根据活化凝血时间(ACT)调节,维持于ACT于160秒~220秒。传统通气组的治疗措施可按照当地的治疗规范实施,均建议使用小潮气量(4~8ml/kg)通气。该研究从2001年7月到2006年8月间共入选180例重症ARDS患者,每组各90例。ECMO组中ECMO平均使用时间为9天。结果发现,ECMO组中6个月内存活且能生活自理者占63%,而传统治疗组仅为47%(P=0.03);对于重症ARDS患者,ECMO能带来更好的成本效益。因此,从该研究可以得出ECMO能挽救大部分早期的重症ARDS患者的生命,改善其生活质量,改善整体的医疗成本效益。但应注意的是,该研究中ECMO的实施是在具有丰富临床ECMO治疗经验的单位内进行的,故该研究结果不一定具有普遍性[6]。
ECMO能取得上述较好的治疗效果,主要与三方面因素相关:ECMO材料和设备技术的进步,准确把握应用指征,规范的操作。
近年来,随着硅胶(silicon rubber)和微孔(microporous)膜式氧合器使用的增加,以往血液相容性很差的鼓泡(bubble)式氧合器已被淘汰。这是ECLA技术从短期治疗发展到长期治疗的一个重要里程碑。特殊涂层的中空纤维膜采用了聚甲基戊烯纤维,并在膜表面使用了很薄的硅胶层密封,可大大地减少血浆渗漏,也增加了氧合器的安全使用时间,如Quadrox D膜肺、MEDOS膜肺和Novalung膜肺等[7-8] 。而生物相容性较好的或肝素化涂层的内表面,可有效减少氧合器内部血栓的形成和大量肝素的应用,从而降低了ECMO的出血风险。此外,离心泵(centrifugal pump)技术的应用,可显著减少滚压泵(roller pump)对血液的破坏[9] 。更小型的ECMO系统的研制,可减少血液与ECMO系统的接触面积以达到降低相关并发症发生的目的,更利于ECMO管理和重症患者的转运。氧合器和驱动泵整合一体产品已上市,这进一步减少了血液与ECMO接触面积,并可以利用驱动泵产生的余热维持体外血液的温度[10] 。曾经需要外科医才能完成的ECMO置管技术,随着经皮穿刺技术的完善,大多数情况下可由熟悉常规血管穿刺置管的ICU医生完成,这使得ECMO更适用于床旁操作[11] 而无泵动静脉ECMO(pumpless arteriovenous ECMO)可完全避免驱动泵相关的并发症和使临床管理更为简单[12] ,此装置很简单,包括一个动脉内置管,一个静脉内置管,两根较短的导管和一个氧合器(如图2)。一个超声流量传感器可以监测进入装置内的血流量。血流量越大,CO2清除越多。但血流量的大小主要取决于平均动脉血压,心输出量和装置的阻力(如氧合器和导管等)。动脉血压的调节可以通过血管活性药物来调节;装置的阻力主要来自氧合器。目前市场中常用的、阻力较低的Novalung膜肺的血流量最大能达到2.0L/min。该装置在降低体内二氧化碳方面具有很好的疗效,但对于纠正低氧血症的效果欠佳,因为进入该装置内的血液已为经过氧合的动脉血。该装置最大的优点是避免了驱动泵相关的并发症(如对血细胞的影响)和使临床管理更为简单。主要缺点包括:不能有效控制血流量;改善低氧血症能力欠佳,除非发生了严重低氧血症;动脉内置管易致下肢缺血坏死,因此动脉内置管一般不超过15号(French)。由于该装置的特点和其工作原理,对于下列患者应视为禁忌:心力衰竭、休克导致的低血压(平均血压<70 mmHg)和严重的外周动脉阻塞疾病。

图2 无泵体外肺辅助装置(图中FA为股动脉,FV为股静脉)
目前ECMO主要用于重症呼吸衰竭患者的补救措施。因有一定的创伤性,花费较高,应严格掌握其治疗适应症。虽然各单位治疗的适应症都有所区别,但总体上都包含有常规治疗方式难以纠正其通气和氧合的早期患者,原发病具有可逆性和常规通气方式的治疗时间较短但病情极重的患者,如早期的重症ARDS、已合并有气压伤等严重机械通气并发症的患者。对于ARDS,目前大部分ECMO中心采用以下标准[13] :①在吸纯氧条件下,氧合指数(PaO2/FiO2)<100,或肺泡动脉氧分压差[P(A-a)O2]>600 mmHg;Murray肺损伤评分≥3.0;②pH<7.2;③年龄<65岁;④传统机械通气时间<7天;⑤无抗凝禁忌;⑥对继续的积极治疗有禁忌。此外,对于需要接受肺移植的终末期肺病患者,也可考虑应用ECMO进行过渡。
除仔细、谨慎选择病例外,还需注意ECMO的规范操作[14-15] 。在ECMO治疗过程中,若出现氧合下降,则主要调节ECMO的血流量和/或氧合器的氧气浓度;而若出现动脉血二氧化碳分压升高,则主要通过调节进入氧合器内新鲜气体的流量,此时尽量不要通过调整呼吸机参数来改善氧合和通气,除非在撤离ECMO阶段。另外需重点提出的是,在ECMO治疗过程中,呼吸机参数的设置和调节应遵循“让肺脏充分休息”的原则:小潮气量(4~6ml/kg),低平台压(<30 cmH2O),一定的PEEP水平(10~15 cmH2O),低呼吸频率(8~12次/分)和低吸氧浓度(FiO2<50%);此外,还应尽量保持肺的开放状态,如使用一定水平的PEEP、避免呼吸机的断开或使用肺复张手法(RM)等。除ECMO及呼吸机参数的设置和调节外,ECMO的更换,ECMO的撤离,抗凝,并发症(出血、血栓、溶血、脱管、导管破裂、驱动泵的障碍等)的防治等都影响ECMO的最终治疗效果。事实上,ECMO所应对的均为病情极重之呼吸衰竭患者,任何一个环节的疏漏,都可能对患者造成不可换回的损失,甚至是致命性的。因此,建立适合本单位的ECMO操作规程,同时培养一个分工明确、协作良好的团队,对于ECMO的成功运转至为重要。
相信随着ECMO技术的成熟和临床应用经验的日益丰富,以及我国呼吸危重症医学和国民经济水平的逐步提高,ECMO将率先在经济发达地区和部分大型医院开展起来,并逐步推广,重症呼吸衰竭患者的治疗感面貌将因此而得到显著改观。
参考文献
1. Brogan TV, Thiagarajan RR, Rycus PT, et al. Extracorporeal membrane oxygenation in adults with severe respiratory failure: a multi-center database. Intensive Care Med, 2009, 35(12):2105-2114.
2. Hill JD, OBrien TG, Murray JJ, et al. Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung.N EnglJ Med, 1972, 286(12):629-634.
3. Zapol WM, Snider MT, Hill JD, et al. Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study. JAMA, 1979, 242(20):2193-2196.
4. Morris AH, Wallace CJ, Menlove RL, et al. Randomized clinical trial of pressure-controlled inverse ratio ventilation and extracorporeal CO2 removal for adult respiratory distress syndrome. Am J Respir Crit Care Med, 1994, 149:295-305.
5. Davies A, Jones D, Bailey M, et al. Extracorporeal Membrane Oxygenation for 2009 Influenza A(H1N1) Acute Respiratory Distress Syndrome. JAMA, 2009, 302(17):1888-1895.
6. Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial.[J]. Lancet, 2009, 374(9698):1351-1363.
7. Eash HJ, Jones HM, Hattler BG, et al. Evaluation of plasma resistant hollow fiber membranes for artificial lungs. ASAIO J, 2004, 50(5):491-497.
8. Peek GJ, Killer HM, Reeves R, et al. Early experience with a polymethyl pentene oxygenator for adult extracorporeal life support. ASAIO J, 2002, 48(5):480-482.
9. Valeri C R, Macgregor H, Ragno G, et al. Effects of centrifugal and roller pumps on survival of autologous red cells in cardiopulmonary bypass surgery. Perfusion, 2006, 21(5):291-296.
10. Cattaneo G, Strauss A, Reul H. Compact intra- and extracorporeal oxygenator developments. Perfusion, 2004, 19(4):251-255.
11. Pranikoff T, Hirschl RB,,Remenapp R,et al.Venovenous extracorporeal life support via percutaneous cannulation in 94 Patients. Chest,1999,115:818–822.
12. Bein T, Zimmermann M, Hergeth K, et al. Pumpless extracorporeal removal of carbon dioxide combined with ventilation using low tidal volume and high positive end-expiratory pressure in a patient with severe acute respiratory distress syndrome. Anaesthesia, 2009, 64(2):195-198.
13. Schuerer DJ, Kolovos NS, Boyd KV, et al. Extracorporeal membrane oxygenation: current clinical practice, coding, and reimbursement. Chest, 2008, 134(1):179-184.
14. Marasco SF, Lukas G, Mcdonald M, et al. Review of ECMO (extra corporeal membrane oxygenation) support in critically ill adult patients. Heart Lung Circ, 2008, 17:S41-S47.
15. Conrad SA, Rycus PT,DaltonH. Extracorporeal Life Support Registry Report 2004. ASAIO J, 2005, 51(1):4-10.
本文作者
|
詹庆元 首都医科大学附属北京朝阳医院 |


